雙自由基共軛聚合物實現(xiàn)生物體內(nèi)高效的NIR-II光熱聯(lián)合免疫抗腫瘤診療

內(nèi)容提要
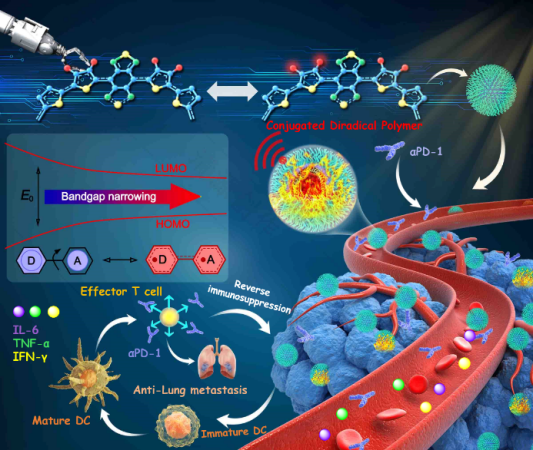
目前報道的有機光熱試劑的光熱轉(zhuǎn)換效率(PCE)仍然相對較低际起,特別是在近紅外二區(qū) (NIR-II拾碌,1000-1700 nm) 窗口具有良好光熱性能的材料仍然很少吐葱,嚴重阻礙了光熱治療在抗腫瘤臨床應(yīng)用中的進一步發(fā)展。本文通過調(diào)節(jié)共軛分子骨架側(cè)鏈校翔,開發(fā)了一種具有超高PCE(87.7%)且穩(wěn)定的共軛雙自由基聚合物納米顆粒弟跑。此外,通過將該納米藥物的NIR-II光熱效應(yīng)與PD-1聯(lián)合使用防症,可以有效地阻止乳腺癌的肺部轉(zhuǎn)移孟辑。這項研究探索了在NIR-II窗口中用于癌癥轉(zhuǎn)移治療診斷的優(yōu)良PTMs,為開發(fā)具有自由基特征的NIR-II光熱材料提供了新的前景蔫敲。
前言
光熱治療(PTT)因其超越傳統(tǒng)治療的非侵入性和時空分辨率特性而被廣泛認為是一種有前途的治療方法饲嗽。為了實現(xiàn)高PTT性能,研究人員已經(jīng)得出了幾種有效策略來設(shè)計優(yōu)異的PTT材料奈嘿,包括共軛延伸貌虾、分子馬達、抑制輻射躍遷和調(diào)控聚集體堆積方式等裙犹。然而尽狠,目前的有機PTT試劑的光熱轉(zhuǎn)換效率(PCEs)仍然相當(dāng)?shù)停绕涫窃?/span>NIR-II(1000-1700nm)窗口中叶圃。此外袄膏,探索用于促進PCE的新設(shè)計機制仍然非常缺乏。因此掺冠,開發(fā)具有高NIR-II性能的新型有機PTT試劑仍然是迫切需要的沉馆。
有機自由基材料自從被報道出來以后,因具備特殊的開殼電子結(jié)構(gòu)赫舒,被開發(fā)用于各種應(yīng)用悍及,主要包括磁性材料闽瓢、有機發(fā)光二極管(OLED)接癌、有機場效應(yīng)晶體管(OFET)和自旋探針。最近的進展表明扣讼,具有開殼雙自由基特征的有機材料通常比具有閉殼的有機材料具有明顯更窄的帶隙缺猛,并賦予有機自由基材料在近紅外應(yīng)用中的巨大前景。目前的報道包括通過超分子主客體相互作用穩(wěn)定增強的有機自由基來開發(fā)近紅外光熱材料以及集成自由基陰離子的晶體金屬有機框架(MOFs)材料椭符,用于光熱治療應(yīng)用荔燎;另外通過分子設(shè)計,穩(wěn)定的含自由基陽離子的共價有機框架(COFs)和有機雙自由基也被探索用于有效的NIR光熱應(yīng)用销钝。然而有咨,目前報道的研究主要集中在NIR-I區(qū)域(700-1000 nm),這限制了其在深層組織的生物醫(yī)學(xué)應(yīng)用蒸健。此外座享,提高有機自由基穩(wěn)定性的新策略仍然很少有報道婉商。因此,探索在NIR-II窗口中具有良好響應(yīng)的穩(wěn)定有機自由基仍然具有挑戰(zhàn)性渣叛。
在這項研究中丈秩,研究者開發(fā)了一種具有87.7%光熱轉(zhuǎn)換效率的共軛雙自由基聚合物,用于在NIR-II窗口中對轉(zhuǎn)移性腫瘤進行有效的光熱免疫治療淳衙。我們通過側(cè)鏈調(diào)節(jié)設(shè)計了D-A共軛雙自由基聚合物(TTB-1和TTB-2)蘑秽,使PTT響應(yīng)從NIR-I向NIR-II紅移。在將共軛雙自由基聚合物組裝成水溶性納米粒子(NPs)后箫攀,TTB-2 NPs實現(xiàn)了87.7%的優(yōu)異光熱轉(zhuǎn)換效率并具有良好的穩(wěn)定性肠牲。體外和體內(nèi)實驗表明,TTB-2 NPs在近紅外窗口實現(xiàn)了高效的腫瘤光消融和光聲成像靴跛,且無任何副作用埂材。此外,通過將TTB-2 NPs的NIR-II PTT與PD-1相結(jié)合汤求,對乳腺癌的肺轉(zhuǎn)移抑制是非常有效的俏险。因此,這項研究為開發(fā)第一個具有有效的NIR-II激活的腫瘤轉(zhuǎn)移光免疫治療診斷的共軛雙自由基聚合物提供了新的前景扬绪。
結(jié)果與討論
通過Stille偶聯(lián)合成了兩種具有典型供體(D)-受體(A)構(gòu)型的共軛雙自由基聚合物(CDPs)竖独。利用密度泛函理論(DFT)計算了兩種CDPs的電子分布和優(yōu)化構(gòu)型, 證明TTB-2具有明顯的共軛平面結(jié)構(gòu)和分子內(nèi)電荷轉(zhuǎn)移的優(yōu)勢。TTB-1和TTB-2都具有良好的雙自由基特征和穩(wěn)定性 (圖1d, e)挤牛。TTB-1在THF溶劑中在750 nm左右有良好的吸收峰莹痢,而TTB-2相對TTB-1有接近200 nm的紅移,最高吸收峰在950 nm附近墓赴。

通過自組裝方法將上述聚合物制備成納米顆粒(圖2a)竞膳。TTB-2 NPs在950 nm處吸收峰最高,而TTB-1 NPs的最大吸收峰位于715 nm處(圖2b)诫硕。透射電子顯微鏡(TEM)和動態(tài)光散射(DLS)結(jié)果證明TTB-2 NPs具有納米球的形態(tài)特征(圖2c)坦辟,并且依然保持雙自由基特性(圖2d)。其次章办,在1064 nm激光的照射下锉走, TTB-2 NPs具有優(yōu)異的光熱性能,光穩(wěn)定性和超高的光熱轉(zhuǎn)換效率藕届,光熱轉(zhuǎn)換效率(PCE)高達87.7%(圖2e-h)挪蹭。進一步理論計算得出開殼層單重態(tài)(OS)的激發(fā)能比閉殼層單重態(tài)(CS)低8.94 kcal mol?1,意味著TTB-2的OS態(tài)具有良好的非輻射躍遷性質(zhì)休偶,與其優(yōu)異的光熱性能保持一致梁厉。

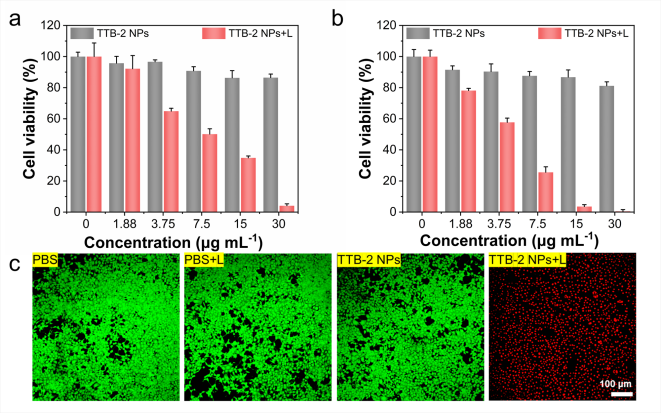
在1064 nm激光照射下,TTB-2 NPs對人宮頸癌(HeLa)細胞和小鼠乳腺癌(4T1)細胞都產(chǎn)生了明顯的光熱消融作用踏兜,在30 μg mL-1濃度時词顾,光熱8分鐘可以導(dǎo)致近95%的細胞被完全殺死只冻。而不照激光的情況下對細胞幾乎無任何毒性,證明了其體內(nèi)良好的安全性和光熱抗腫瘤潛力计技。腫瘤細胞活/死雙染實驗(圖3c)也同樣證明了TTB-2 NPs在NIR-II區(qū)良好的抗腫瘤細胞增殖性能和生物安全性喜德。
對4T1荷瘤小鼠靜脈注射TTB-2 NPs進行PA成像,觀察到TTB-2 NPs的信號在注射后9 h出現(xiàn)明顯的峰值垮媒;24 h后幾乎完全從腫瘤部位消失舍悯。腫瘤熱成像結(jié)果表明在激光照射5分鐘后,注射TTB-2 NPs后9小時并用1064 nm照射小鼠的腫瘤溫度迅速升高至53℃睡雇,而PBS+L處理的小鼠的腫瘤溫度變化不大萌衬。之后對4T1荷瘤小鼠進行體內(nèi)PTT治療。TTB-2 NPs聯(lián)合激光照射治療組小鼠的腫瘤在治療后幾乎完全消融它抱,并且在治療后的14天內(nèi)沒有復(fù)發(fā)秕豫。相比之下,單獨給予TTB-2 NPs或Laser對腫瘤生長無明顯影響观蓄。不同治療后小鼠腫瘤的蘇木精和伊紅(H&E)染色顯示TTB-2 NPs光熱治療誘導(dǎo)引發(fā)腫瘤部位明顯的核分裂和核壞死(圖4g)混移。此外,TUNEL和PCNA染色也表明TTB-2 NPs的光療消融腫瘤效果侮穿。

通過聯(lián)合αPD-1(抗PD-1抗體)在侵襲性肺轉(zhuǎn)移瘤模型中評估TTB-2 NPs的抗腫瘤轉(zhuǎn)移活性歌径。于治療后第18天采用流式細胞術(shù)檢測不同治療后腫瘤細胞CD8+細胞毒性T淋巴細胞(CTL)和成熟樹突狀細胞(DC) (CD80+CD86+)的變化,發(fā)現(xiàn)TTB-2 NPs 光熱聯(lián)合免疫治療的CTL和成熟DC細胞明顯高于其他組亲茅,證明TTB-2 NPs 光熱聯(lián)合免疫治療可促進DC成熟回铛,增強全身抗腫瘤免疫應(yīng)答。酶聯(lián)免疫吸附試驗(ELISA)檢測血清中細胞因子和促炎介質(zhì)的水平證明TTB-2 NPs PTT聯(lián)合αPD-1免疫治療后小鼠血清IL-6克锣、TNF-α茵肃、IFN-γ水平有不同比例的升高。各種治療后進一步分析乳腺癌的肺部轉(zhuǎn)移袭祟。除光熱聯(lián)合免疫治療組外验残,其他各組小鼠肺中均出現(xiàn)明顯的白色結(jié)節(jié),而TTB-2 NPs + PTT + αPD-1聯(lián)合治療后小鼠肺部轉(zhuǎn)移瘤明顯受到抑制榕酒。這些結(jié)果表明TTB-2 NPs 光熱聯(lián)合免疫療法可有效激活免疫應(yīng)答胚膊,用于抗轉(zhuǎn)移性乳腺癌腫瘤的治療故俐。

結(jié)論
本研究通過設(shè)計共軛雙自由基聚合物的側(cè)鏈位置想鹰,雙自由基TTB-2的吸收能夠擴展到NIR-II區(qū)域∫┌妫基于87.7%的超高NIR-II光熱轉(zhuǎn)換效率辑舷,進一步證明了TTB-2納米粒子在體外和體內(nèi)通過NIR-II光照射可以實現(xiàn)良好的腫瘤抑制和光聲(PA)成像性能。此外槽片,與PD-1治療相結(jié)合何缓,TTB-2納米顆粒實現(xiàn)了抑制體內(nèi)乳腺癌肺轉(zhuǎn)移的有效光免疫效應(yīng)肢础。因此,這種共軛雙自由基聚合物豐富了近紅外-紅外窗口的PTT試劑碌廓,并為雙自由基材料的開發(fā)提供有益的見解传轰。
參考文獻
Gao, Y., Liu, Y., Li, X. et al. A Stable Open-Shell Conjugated Diradical Polymer with Ultra-High Photothermal Conversion Efficiency for NIR-II Photo-Immunotherapy of Metastatic Tumor. Nano-Micro Lett. 16, 21 (2024). https://doi.org/10.1007/s40820-023-01219-x